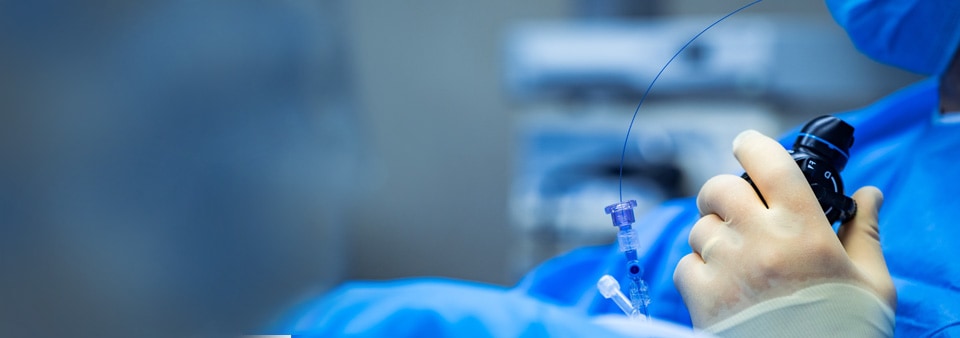
In qualità di produttori di dispositivi medici vascolari, una delle sfide più importanti per entrare o continuare ad avere successo in questo mercato è la gestione efficiente del processo normativo. Prove cliniche solide e statisticamente rilevanti che dimostrino la sicurezza e le prestazioni del vostro dispositivo che confermino le indicazioni cliniche, l'uso previsto e la popolazione di pazienti a cui il dispositivo è destinato sono essenziali per garantire il successo della vostra richiesta.
I nostri Technical Specialist vascolari sono esperti di prodotto altamente qualificati a lavorare con i produttori di dispositivi medici vascolari e a comprendere le specificità di questi dispositivi complessi. Abbiamo grande esperienza nel lavorare con apparecchi, dispositivi, impianti, strumenti e altri articoli destinati a essere utilizzati nel sistema vascolare. Forniamo anche valutazioni di conformità per dispositivi medici per il cuore stesso, utilizzati per la diagnosi, la prevenzione, il monitoraggio, il trattamento e l'alleviamento di malattie o lesioni, nonché per lo studio, la sostituzione o la modifica dell'anatomia in relazione ai vasi o al cuore. Quando sono necessarie ulteriori competenze, collaboriamo con i nostri esperti interni di tutti i settori dei dispositivi medici.