Un grande interesse verso la sicurezza del paziente
La nostra missione è garantire la sicurezza dei pazienti, sostenendo al contempo un accesso tempestivo al mercato delle tecnologie mediche in modo sostenibile. Ci sforziamo di definire standard globali attraverso valutazioni di conformità, valutazioni e certificazioni approfondite, reattive e solide, riconosciute e affidabili in tutto il mondo.
BSI The Netherlands (2797) è uno dei principali Organismi Notificati; esaminiamo i dispositivi medici per assicurarci che siano conformi ai requisiti delle Direttive e dei Regolamenti Europei. BSI UK (0086) è un organismo approvato del Regno Unito in grado di fornire valutazioni di conformità nell'ambito del nuovo schema UKCA.
Mantenere la qualità, generare eccellenza; BSI Medical Devices offre servizi di certificazione per supportare i tuoi obiettivi di accesso al mercato globale.
Noi siamo:
- Un Organismo Notificato europeo
- Un Organismo Approvato nel Regno Unito
- Un organismo di certificazione accreditato ISO 13485
- Un'organizzazione di revisione riconosciuta nell'ambito del programma MDSAP (Medical Device Single Audit Program)
- Un organismo di certificazione riconosciuto in molti mercati globali
Supporto durante l'intero ciclo di vita del prodotto
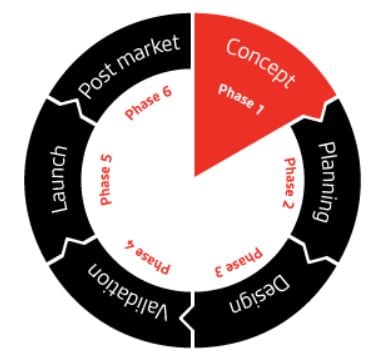 Indipendentemente dalla fase in cui ti trovi, BSI può collaborare con te per ridurre al minimo il rischio aziendale e garantire la conformità.
Indipendentemente dalla fase in cui ti trovi, BSI può collaborare con te per ridurre al minimo il rischio aziendale e garantire la conformità.
Parla con noi in anticipo per sfruttare la nostra gamma completa di servizi.