BSI Electronic Client Portal
Stiamo modificando le modalità di caricamento della documentazione sul BSI Electronic Client Portal, utilizzato dai clienti BSI per caricare i rapporti di vigilanza e la documentazione tecnica. Il portale includerà funzionalità aggiuntive per consentire ai produttori di caricare singoli documenti come richiesto per EUDAMED.
- I produttori potranno inviare i documenti SS(C)P a fronte di uno o più numeri di certificato, specificando al contempo le UDI-DI di base coperte dai documenti SS(C)P. Si prega di non inviare le traduzioni dei documenti SS(C)P fino a quando BSI non invierà la notifica dell'inizio del caricamento su EUDAMED.
- I produttori potranno presentare un documento PSUR a fronte di uno o più numeri di certificato, specificando le UDI-DI di base coperte da tali PSUR. I PSUR per i dispositivi di classe III, impiantabili e di classe
classe D devono essere inviati tramite il portale fino a quando EUDAMED non sarà disponibile per l'invio.
I produttori possono accedere alle istruzioni su come inviare questi documenti una volta effettuato l'accesso al BSI Electronic Client Portal.l.
Certificati MDR/IVDR - Formato a quattro date
In futuro, tutti i certificati IVDR e MDR di BSI riporteranno quattro date:
- Data di prima emissione
- Data di emissione corrente
- Data di inizio validità
- Data di scadenza
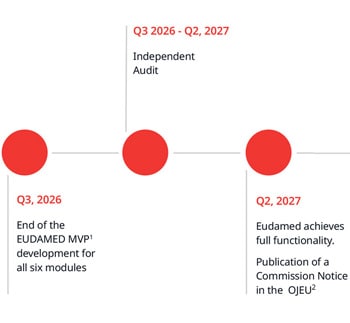
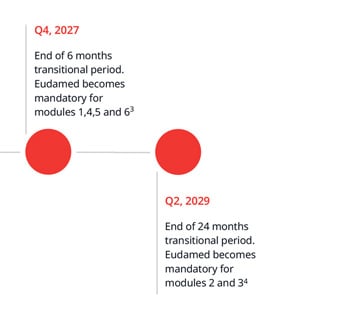
Questa modifica sarà applicata a tutti i certificati MDR/IVDR emessi o riemessi d'ora in poi. Il formato a quattro date è necessario per allinearsi ai requisiti di registrazione dei certificati in EUDAMED.

La tabella seguente mostra un confronto tra l'attuale formato a tre date e il nuovo formato a quattro date:
I certificati MDR/IVDR già emessi con il formato a tre date continuano a essere validi e saranno convertiti al formato a quattro date quando verranno riemessi (per qualsiasi motivo).
Questo cambiamento non riguarda i certificati UKCA e EU Directive, che continueranno a utilizzare il formato a tre date.
Subappaltatori critici e fornitori cruciali
Gli attuali certificati MDR/IVDR basati sugli allegati dei sistemi di qualità rilasciati da BSI, come l'allegato IX capitolo I e III, includono pagine supplementari che elencano i subappaltatori critici e i fornitori cruciali associati ai prodotti coperti dagli scopi di tali certificati. Per fugare ogni preoccupazione di riservatezza, i certificati MDR/IVDR, in futuro, non includeranno queste informazioni supplementari sui subappaltatori/fornitori. Al contrario, BSI manterrà queste informazioni all'interno dei registri interni.
Il processo di approvazione delle modifiche ai subappaltatori/fornitori critici non subisce modifiche. I produttori devono continuare a notificare a BSI qualsiasi intenzione di apportare modifiche ai loro subappaltatori e fornitori critici durante la validità del certificato.
Tutti i certificati MDR/IVDR basati sul sistema qualità emessi o riemessi d'ora in poi non includeranno le informazioni sui subappaltatori/fornitori come descritto sopra. Gli attuali certificati MDR/IVDR già emessi con queste informazioni continueranno a essere validi e saranno passati a non avere le informazioni sui subappaltatori/fornitori la prossima volta che saranno riemessi (per qualsiasi motivo).
BSI applicherà i principi di cui sopra anche ai certificati UKCA e alle direttive UE, per mantenere un approccio armonizzato in tutte le legislazioni.
Altre modifiche previste per i certificati e il processo di approvazione BSI
Le modifiche di seguito elencate dovrebbero essere attuate nei prossimi mesi, prima che BSI inizi a inviare le informazioni a EUDAMED.