Réponse de la MHRA à la consultation sur la future législation UKCA
Date : 17 octobre 2022
Nous avons reçu un certain nombre de questions concernant la réponse à la consultation de la MHRA sur la future législation UKCA - nous avons donc voulu prendre contact avec vous pour clarifier la situation actuelle.
La réponse à la consultation de la MHRA indique la pensée du gouvernement britannique sur l'orientation de la future législation - mais pour être très clair, elle n'est pas définitive et n'est pas encore légale.
Dans le cadre de la réponse à la consultation, certains points clés ont été abordés, notamment les dispositions transitoires potentielles (voir ci-dessous). Comme vous pouvez le constater, les délais transitoires proposés peuvent offrir une certaine marge de manœuvre et être particulièrement bénéfiques pour certains fabricants, notamment ceux qui ont achevé leur transition vers le MDR et l'IVDR ou qui le feront avant juillet 2023.
Délais transitoires
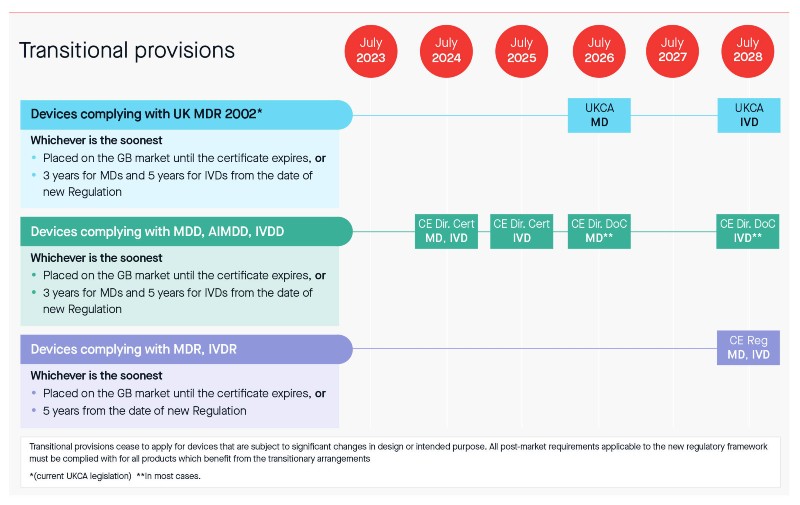
En tant que fabricants, vous avez le choix de décider de l'approche qui vous convient le mieux en tenant compte des éléments suivants :
Les types de dispositifs que vous possédez.
Les dates d'expiration de votre certificat de directive.
Vos progrès dans la transition vers MDR/IVDR.
Votre style de travail unique.
BSI continuera à prendre en charge les demandes d'UKCA dans le cadre des législations actuelles au cas par cas, veuillez contacter votre BDM pour plus de détails. Vous pouvez également trouver de plus amples informations sur la législation UKCA sur notre page web dédiée.
Bien que BSI ne puisse pas conseiller les fabricants sur ce qu'ils doivent faire, nous sommes disponibles pour répondre à toutes vos questions concernant cette transition. N'hésitez pas à contacter votre responsable de programme pour toute question.
Cordialement,
Vishal Thakker
Head of UK Approved Body & Senior Regulatory Lead, Regulatory Services (Dispositifs médicaux)


