Dispositifs sous certificats AIMDD/MDD à partir du 26 mai 2021
Actualité : 10 juin 2021
Le Règlement Dispositifs Médicaux (MDR) EU 2017/745 est entré en vigueur le 26 mai 2021. L'article 120 du MDR contient des dispositions transitoires spécifiques concernant les dispositifs qui continuent d'être mis sur le marché en vertu de la Directive sur les dispositifs médicaux implantables actifs (AIMDD) 90/385/EEC ou la directive sur les dispositifs médicaux (MDD) 93/42/EEC et pour les certificats délivrés en vertu de cette législation.
Nous aimerions fournir des recommandations supplémentaires sur deux sujets spécifiques liés à l'article 120 du MDR :
- signaler les changements pour les dispositifs qui continuent d'être certifiés sous l'AIMDD et la MDD ;
- et les modifications apportées aux certificats AIMDD et MDD délivrés par BSI Pays-Bas (NB 2797) à partir du 26 mai 2021.
Signalement des modifications à l'Organisme Notifié pour les dispositifs couverts par les certificats AIMDD/MDD à partir du 26 mai 2021
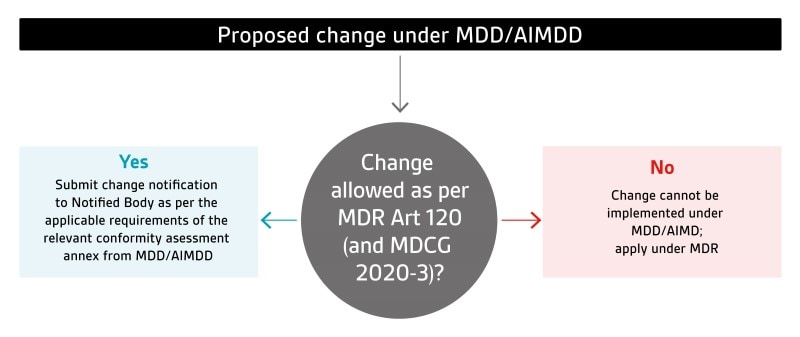
L'article 120.3 du MDR stipule que les dispositifs couverts par des certificats AIMDD/MDD valides peuvent continuer à être commercialisés sur le marché ou mis en service jusqu'au 26 mai 2024 tant qu'ils continuent de répondre aux exigences de cette législation et qu'il n'y a pas de changements significatifs dans leur conception ou le but visé. Veuillez vous référer au MDCG 2020-3 pour des conseils supplémentaires sur ce qui constitue un changement important dans la conception ou l'objectif prévu.
Pour ces dispositifs, les fabricants doivent adapter/mettre à jour leurs processus et procédures de notification des modifications afin de respecter à la fois les dispositions transitoires du MDR et les exigences de notification des modifications en vertu des annexes d'évaluation de la conformité applicables de la législation pertinente (AIMDD ou MDD). Les mises à jour des processus/procédures et leur mise en œuvre seront vérifiées lors des audits de surveillance de routine de BSI. Dans les cas où il n'est pas clair si une modification proposée peut être effectuée dans le cadre de l'AIMDD/MDD ou non, il est recommandé que le fabricant parvienne à une conclusion préliminaire sur la base de son analyse et la soumette à l'organisme notifié (via le formulaire de notification de changement MDF4900) pour confirmation avant la mise en œuvre du changement.
Modifications des certificats AIMDD/MDD délivrés par BSI Pays-Bas (NB 2797) à partir du 26 mai 2021
Le MDCG 2020-3 stipule que les organismes notifiés ne sont pas autorisés à délivrer de nouveaux certificats AIMDD/MDD ou à modifier/modifier/compléter les certificats existants à partir du 26 mai 2021. Il est suggéré que les organismes notifiés confirment par écrit tout changement qui a été examiné et approuvé à partir du 26 mai 2021 et que cette confirmation écrite corrige ou complète les informations sur un certificat existant délivré avant le 26 mai 2021.
Conformément aux directives ci-dessus, BSI n'apportera aucune modification aux pages principales des certificats AIMDD/MDD à partir du 26 mai 2021. Toute modification examinée et approuvée sera communiquée de la manière suivante :
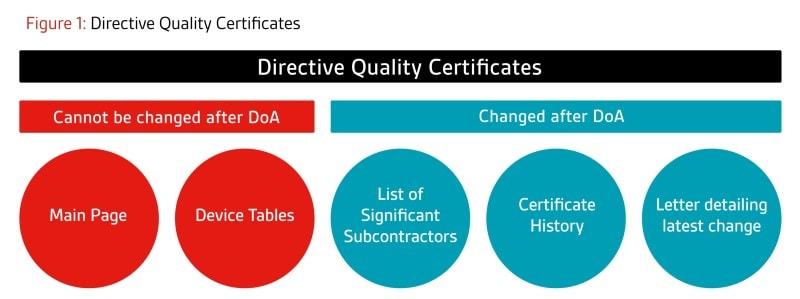
- Certificats basés sur les annexes du système qualité (par exemple, certificats d'assurance qualité complète) :
e certificat principal restera inchangé. Les pages supplémentaires telles que la page Sous-traitant important et la page Historique continueront d'être mises à jour au besoin, car elles ne sont pas considérées comme faisant partie du certificat principal. De plus, une lettre sera publiée à la fin de chaque projet décrivant les dernières modifications approuvées dans le cadre de ce projet.
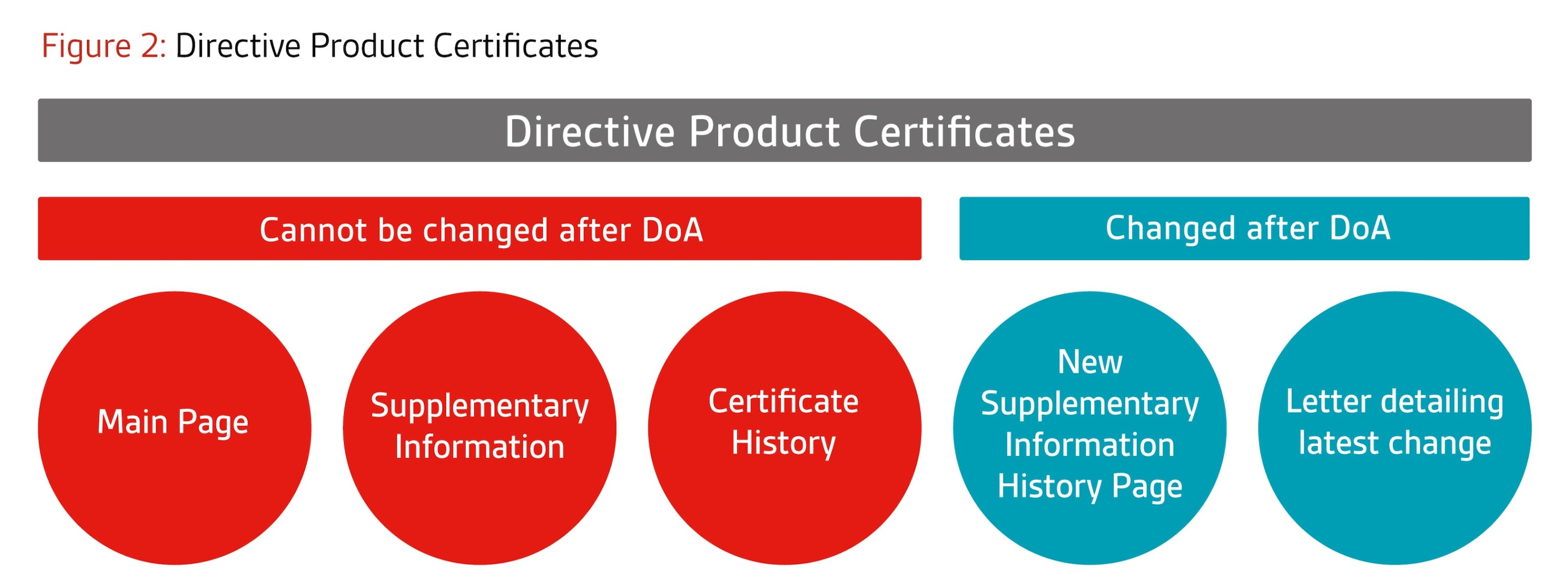
- Certificats basés sur des annexes de produits (par exemple, certificats d'examen de conception) : Le certificat principal restera inchangé. Une nouvelle page supplémentaire sera publiée pour capturer l'historique des modifications. De plus, une lettre sera émise à la fin de chaque projet décrivant le(s) dernier(s) changement(s) approuvé(s) dans le cadre de ce projet.
Autre information
Il est également important de rappeler que pour tous les dispositifs commercialisés sur le marché jusqu'au 26 mai 2024 ou mis en service jusqu'au 27 mai 2025 dans le cadre de l'AIMDD/MDD, les exigences du MDR relatives à la surveillance post-commercialisation, la surveillance du marché, la vigilance, l'enregistrement des opérateurs et de dispositifs (en fonction de la disponibilité d'EUDAMED) s'appliquent à la place des exigences correspondantes de ces directives. Ces exigences du MDR s'appliqueront même si ces appareils ne sont pas en cours de transition vers le MDR. La mise en œuvre de ces exigences par les fabricants sera vérifiée lors des audits de surveillance de routine de BSI.
Qui puis-je contacter pour avoir plus d'informations ?
Si vous avez des questions ou des préoccupations, nous vous recommandons d'utiliser le matériel gratuit référencé en premier lieu. Votre Scheme Manager BSI peut vous fournir de plus amples informations si vous avez encore des questions.


