La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) sobre el periodo de espera del marcado UKCA
Fecha: 01 de noviembre de 2022
El 21 de octubre de 2022, la MHRA anunció oficialmente una prórroga de doce meses del actual periodo de espera para cumplir con la normativa de marcado de UKCA. A partir del 1 de julio de 2024, se aplicarán disposiciones legislativas transitorias para la comercialización de todos los productos sanitarios y productos sanitarios de diagnóstico in vitro en el mercado de Gran Bretaña. Consulte el calendario transitorio revisado a continuación (sujeto a cambios):
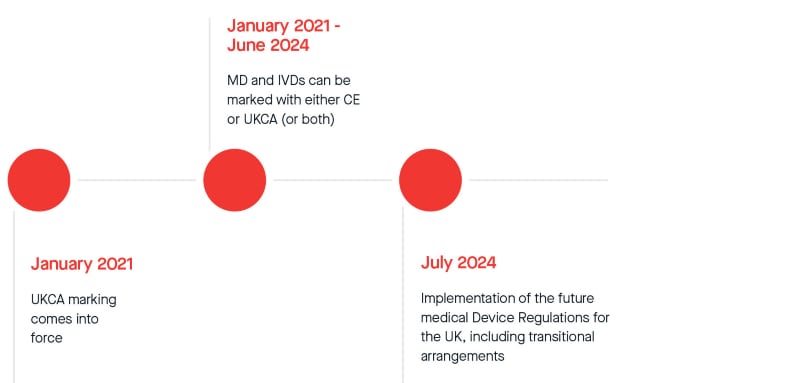
A pesar de la posible tranquilidad que aporta esta prórroga, le instamos encarecidamente a que siga presentando su propuesta firmada y presente el conjunto pertinente de documentación técnica totalmente conforme lo antes posible para minimizar el riesgo de no completar el trabajo a tiempo. Programaremos y realizaremos las revisiones lo antes posible en función de la disponibilidad de los revisores. Tenga la seguridad de que nos centramos en la capacidad de nuestros revisores para poder satisfacer las demandas de certificación con la mayor eficacia posible.
Nuestra prioridad sigue siendo mantener la seguridad de los pacientes y garantizar el cumplimiento de las revisiones de todos los productos dentro de los marcos normativos actuales y futuros.
Si necesita información adicional en relación con la presentación de sus solicitudes del marcado UKCA, póngase en contacto con su gestor del proyecto.
Encontrará más información en GOV.UK y en nuestra página web dedicada al marcado UKCA.
Atentamente,
Vishal Thakker
Head of UK Approved Body & Senior Regulatory Lead, Regulatory Services (Medical Devices)



