Enmiendas al IVDR y política relativa a los IVD de clase D
Fecha: 20 de marzo de2023
El 20 de marzo de 2023 se publicó en el Diario Oficial de la Unión Europea (DOUE), con efecto inmediato, el Reglamento (UE) 2023/607 por el que se modifican el MDR y el IVDR. El objetivo del Reglamento de modificación es abordar los riesgos inminentes previstos de escasez de productos sanitarios en la UE debido a la transición más lenta de lo previsto de las Directivas sobre productos sanitarios al MDR y el IVDR.
Enmienda sobre el IVDR
Se han suprimido las medidas relativas a la comercialización especificadas en el artículo 110.4 del Reglamento sobre productos sanitarios IVD para permitir que los productos sanitarios IVD heredados ya comercializados con arreglo a las Directivas sigan estando disponibles sin fecha límite.
BSI sobre la implantación del Reglamento (UE) 2022/112, incluida la última modificación del IVDR
BSI celebra la última Enmienda del Reglamento, así como el Reglamento (UE) 2022/112 publicado el año pasado, ya que garantizan el acceso al mercado de productos sanitarios IVD seguros, al tiempo que proporcionan tiempo adicional a los fabricantes y organismos notificados para completar la transición de los productos al IVDR. BSI está trabajando internamente, y en paralelo, trabajando muy estrechamente con las Autoridades de la UE, y otros organismos notificados para desarrollar una interpretación común de la nueva modificación del Reglamento, desarrollar plantillas y apoyar la implantación armonizada de la nueva modificación del Reglamento en todos los organismos notificados.
Los plazos más importantes, incluida la enmienda anterior (UE) 2022/112, son los siguientes:
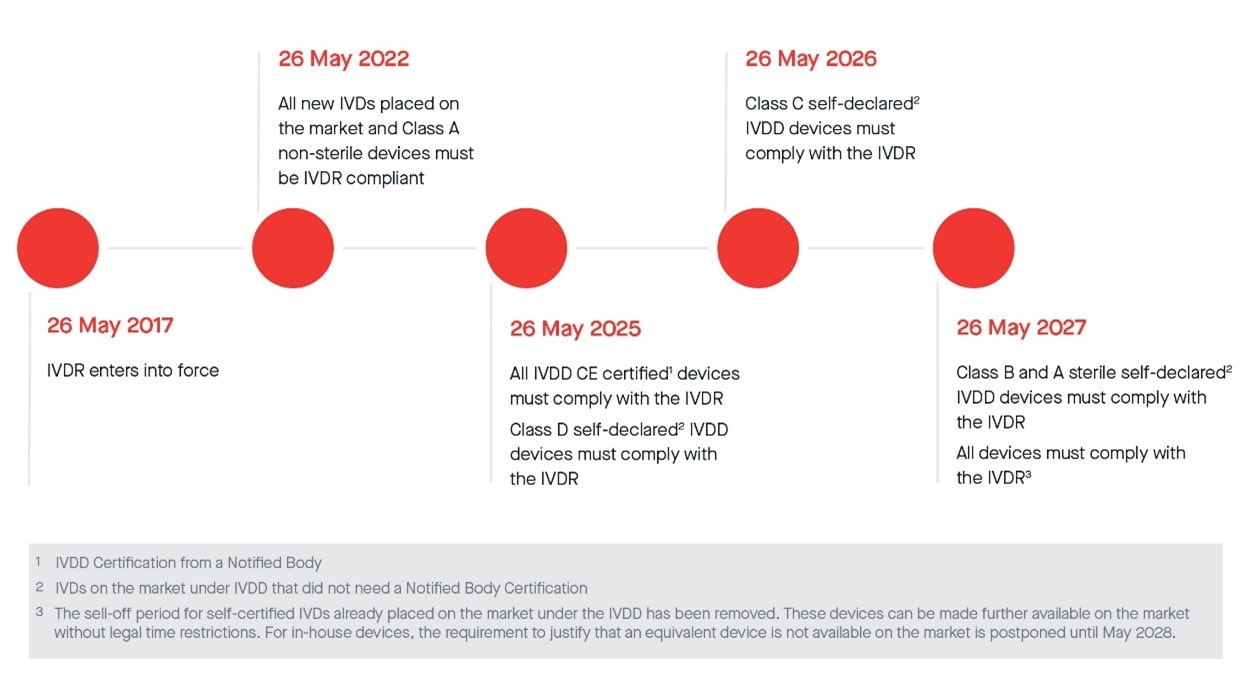
Política sobre los IVD de clase D, a la espera de la designación de los laboratorios europeos de referencia (EURL)
Como ya saben, BSI ha adoptado una estrategia de transición a la Clase D basada en el riesgo, por la que participamos activamente en la evaluación de la conformidad de los productos. Estamos adoptando las medidas descritas en Team-NB/NBCG Med Position Paper caso por caso dependiendo del historial de evaluación de conformidad de los fabricantes, el riesgo del producto y la novedad de la tecnología.
Mientras esperamos a que se designen los EURL, BSI se compromete a explorar formas de reducir el riesgo de certificar productos de clase D sin la verificación de un laboratorio independiente y sin reducir el nivel de escrutinio defendido por IVDR. Una vez que se designen los EURL, realizaremos una transición activa de los productos de clase D al nuevo marco.
Se recomienda a los fabricantes que no pospongan/retrasen sus planes de IVDR
Con el fin de aprovechar al máximo la capacidad actualmente disponible para completar la transición al IVDR, BSI recomienda encarecidamente que los fabricantes que ya hayan realizado o planificado sus solicitudes de IVDR y presentaciones de documentación con BSI de acuerdo con la legislación de enero de 2022, no se desvíen de sus planes, e insta encarecidamente a otros fabricantes que aún no hayan realizado sus solicitudes de IVDR a que las presenten lo antes posible por las siguientes razones:
- Retrasar o cambiar sus presentaciones previstas actuales significará que las presentaciones se añadirán al final de la cola de revisión, por lo que se enfrentará al riesgo de retraso en la evaluación de la conformidad y al posible riesgo de no completar el trabajo antes de que finalice el período de transición
- Los fabricantes no están autorizados a introducir cambios significativos en el diseño o la finalidad prevista de sus productos existentes durante las disposiciones transitorias.
El trabajo de Documentación Técnica se asigna a revisores cualificados para los códigos IVR/IVP/IVS/IVD específicos (o combinaciones de los mismos) aplicables a cada presentación, por lo que el plazo de asignación e inicio de una revisión varía en función de la carga de trabajo existente y entrante. Programaremos y llevaremos a cabo las revisiones lo antes posible en función de la disponibilidad de los revisores. Durante una revisión, responder a las preguntas de manera oportuna garantizará que la cadencia de su programa de revisión sea lo más eficiente posible.
Tenga la seguridad de que trabajamos en nuestra capacidad para satisfacer la demanda de certificación con la mayor eficacia posible.
¿Dónde puedo encontrar más información?
Puede visitar nuestra página web dedicada al IVDR para acceder a información adicional y recursos de apoyo. Si tiene más preguntas, póngase en contacto con su gestor.
Nuestra prioridad sigue siendo mantener la seguridad de los pacientes y garantizar evaluaciones de conformidad conformes para todos los productos dentro del nuevo marco reglamentario. BSI quiere agradecerle todos sus esfuerzos y el progreso realizado en los últimos años, y espera trabajar con usted para completar sus transiciones reglamentarias a su debido tiempo.
Atentamente,
Alex Laan
Head of the IVD Notified Body



