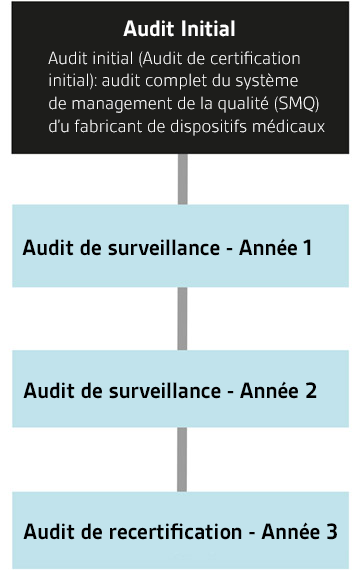
Le Medical Device Single Audit Program (MDSAP) permet un audit unique du système de gestion de la qualité (QMS) d'un fabricant de dispositifs médicaux, qui satisfait aux exigences de plusieurs juridictions réglementaires. Les audits sont menés par des organismes d'audit (AO) tels que BSI, qui sont autorisés par les autorités réglementaires (AR) participantes à auditer conformément aux exigences du MDSAP.
Le MDSAP est un moyen permettant aux fabricants de dispositifs médicaux d'être audités une fois pour vérifier leur conformité aux exigences standard et réglementaires de cinq marchés différents : Australie, Brésil, Canada, Japon et États-Unis.
Un audit BSI MDSAP peut également être combiné avec une évaluation pour le marquage CE et l'ISO 13485.
Les audits MDSAP peuvent être effectués par un AO MDSAP reconnu, tel que BSI. Nous avons été actifs depuis le début de la phase pilote du MDSAP et avons désormais réalisé un grand nombre d'audits MDSAP, principalement pour des fabricants de dispositifs médicaux.