Meu software é um dispositivo médico?
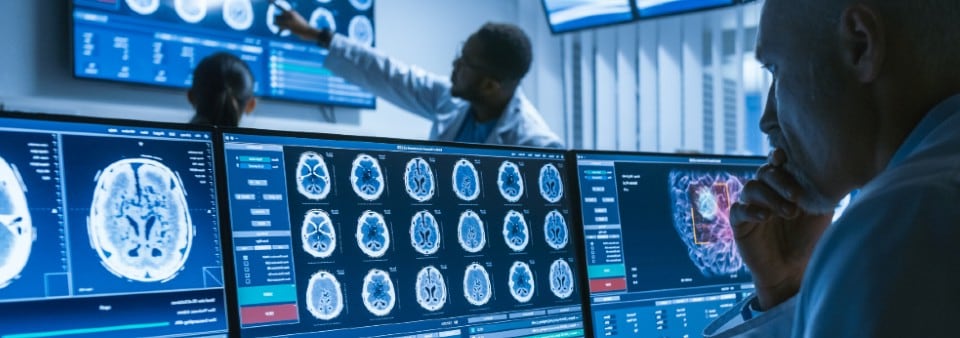
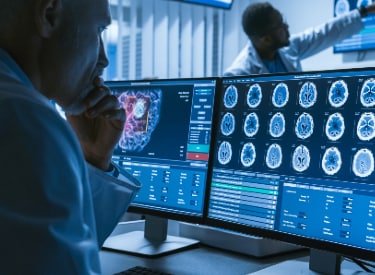
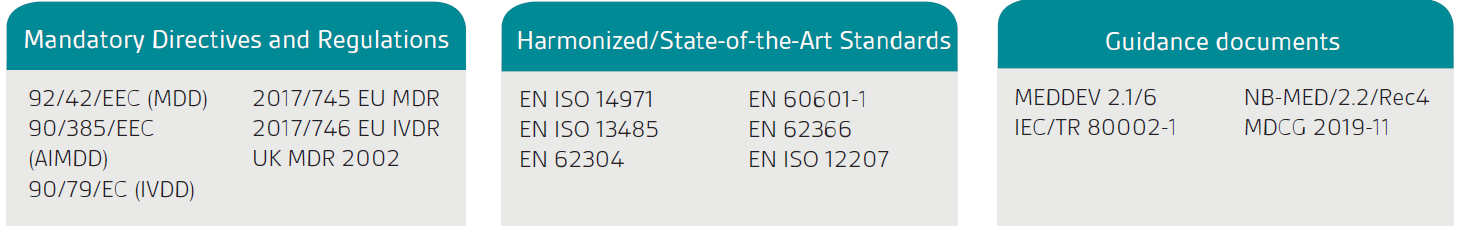
A primeira etapa é confirmar que seu produto ou serviço está legalmente classificado como um SaMD; o produto deve primeiro ter um propósito declarado que seja médico, conforme definido pelas Diretrizes e Regulamentos de Dispositivos Médicos na UE e pelo Regulamento de Dispositivos Médicos do Reino Unido (UK MDR) 2002.
A orientação da Comissão Européia, MEDDEV 2.1/6, é aplicável somente a software autônomo.
Como indicado na MDD/MDR da UE e na MDR do Reino Unido, o software autônomo que tem uma finalidade médica é considerado um dispositivo médico ativo. A classificação depende do risco para o paciente e para os usuários. Para classificar seu software por completo, você precisará rever as regras de classificação relevantes.