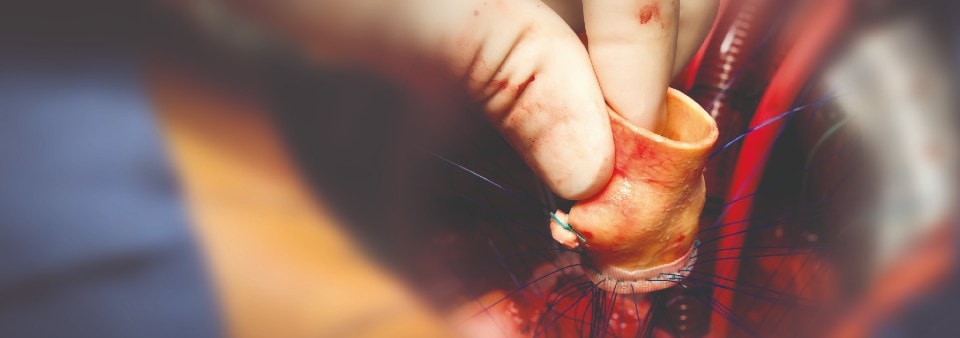
Was sind unter Verwendung von tierischem Gewebe hergestellte Medizinprodukte?
Tierische Gewebe und ihre Derivate werden in den Medizinprodukten verwendet, weil sie bestimmte Leistungsmerkmale besser als Materialien erreichen, die nicht tierischen Ursprungs sind.
Die verwendeten Arten und Mengen von Materialien tierischen Ursprungs in den Medizinprodukten können sehr unterschiedlich sein. Diese Materialien können einen Großteil des Produktes ausmachen (z. B. Herzklappen von Rindern oder Schweinen, Knochenersatzmaterialien für die Verwendung in dentalen oder orthopädischen Anwendungen, hämostatische Produkte), zur Beschichtung oder Imprägnierung des Produktes verwendet werden (z. B. Kollagen, Gelatine, Heparin) oder während des Herstellungsverfahren des Produktes zum Einsatz kommen (z. B. Talgderivate wie Oleate und Stearate, fetales Kälberserum, Enzyme, Kulturnährböden).