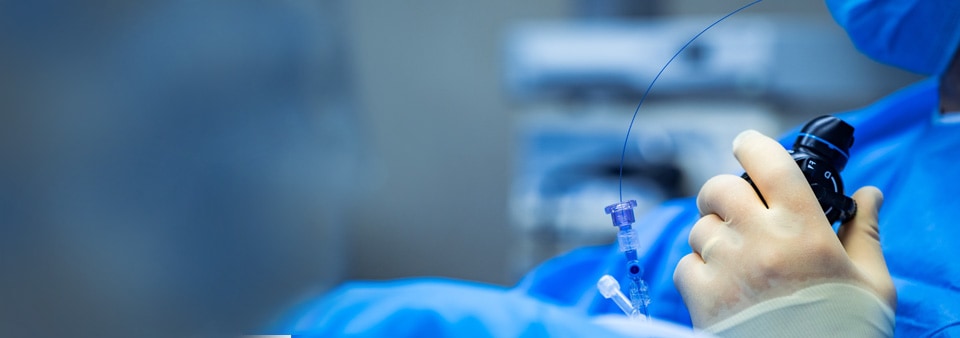
心血管医疗器械包括哪些?
心血管医疗器械可定义为用于动脉和静脉或心脏的一种器械,可控制、诊断、监测或改善疾病、损伤或其他状况。心血管系统包括心脑血管、外周血管和神经血管解剖学。
有关心血管和相关医疗器械的更多信息,请参考:
- 欧盟医疗器械法规Europe Medical Device Regulation (EU MDR) 2017/745
- 英国医疗器械法规Part II of the Medical Devices Regulations 2002 (as amended) for Great Britain