将通用医疗器械投放市场
作为医疗器械制造商,您必须在产品上市之前确保其满足相关法规要求。选择一家了解行业,并具有丰富评审经验的欧盟公告机构或英国授权机构至关重要。
BSI荷兰(2797)是全球领先的欧盟公告机构,我们对医疗器械进行评审以确保它们符合欧盟指令和法规的要求。BSI英国(0086)是英国授权机构,能够根据新的UKCA认证方案提供符合性评审。
Suggested region and language based on your location
Your current region and language
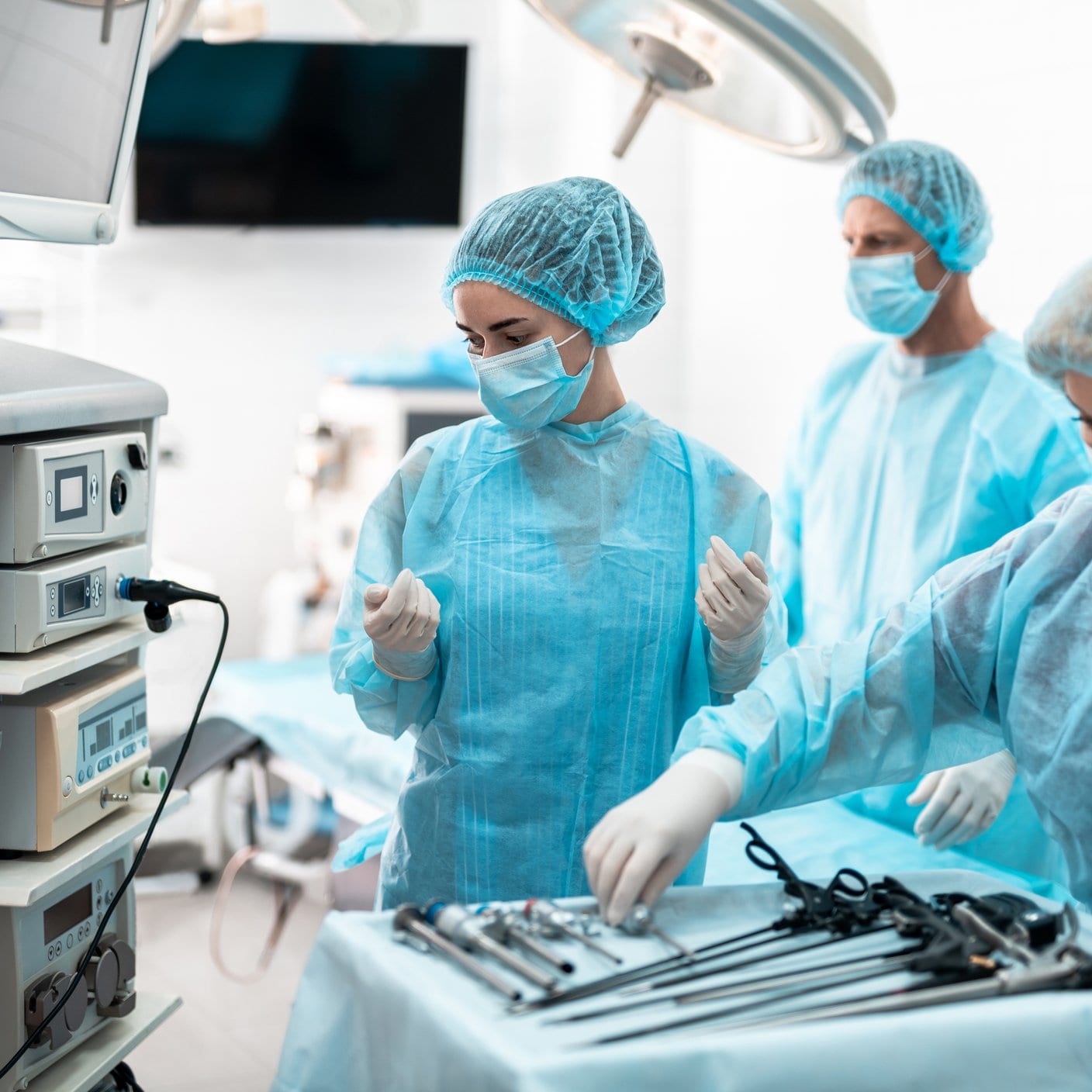
将医疗器械投放市场。
作为医疗器械制造商,您必须在产品上市之前确保其满足相关法规要求。选择一家了解行业,并具有丰富评审经验的欧盟公告机构或英国授权机构至关重要。
BSI荷兰(2797)是全球领先的欧盟公告机构,我们对医疗器械进行评审以确保它们符合欧盟指令和法规的要求。BSI英国(0086)是英国授权机构,能够根据新的UKCA认证方案提供符合性评审。
我们的技术专家团队精通各类医疗器械的专业知识。以下是通用团队支持的部分器械:
无源软组织植入式医疗器械。
伤口和皮肤护理医疗器械。
眼科医疗器械。
输液和输血医疗器械。
MDR附录16医疗器械。
其他医疗器械。
EU MDR和UK MDR 2002的引入给制造商带来了巨大的挑战。
无论您是刚开始启动认证,还是希望转移认证,或者只是需要讨论贵公司面临的各种选择,我们都能为您提供帮助。
