BSI拥有5,000名员工,在超过193个国家/地区拥有12,000名行业专家。我们的法规服务结合世界领先的经验,为您提供器械上市的有效途径。
- 搜索BSI
- 验证证书
Suggested region and language based on your location
Your current region and language
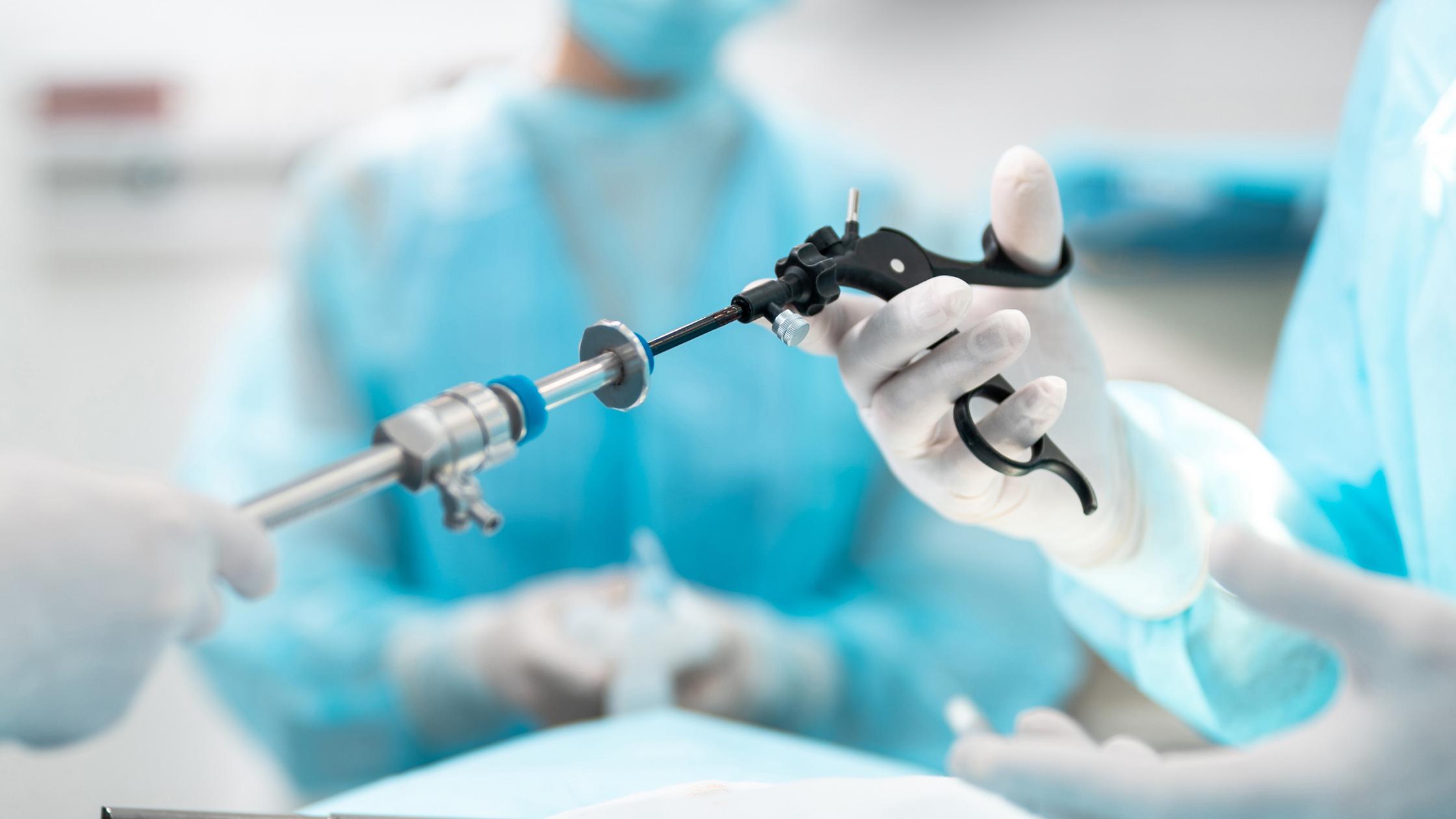
保障患者安全,同时为医疗技术的市场准入提供及时、可持续的服务支持。
BSI拥有5,000名员工,在超过193个国家/地区拥有12,000名行业专家。我们的法规服务结合世界领先的经验,为您提供器械上市的有效途径。
BSI医疗器械提供认证服务,助您实现全球市场准入目标。我们是:

下载自2025年1月1日起生效的IVDR和MDR符合性评审费用。

BSI Assurance UK Ltd、BSI Group The Netherlands B.V.和BSI Group America Inc.是经第三方认证/认可的认证机构(英国皇家认可委员会(UKAS)、荷兰认证委员会(RvA)和医疗器械单一审核方案(MDSAP)),提供管理体系评审和认证。
选择代表您所处产品生命周期的阶段,帮助您确定应该考虑哪些其他因素。
符合性评审通常包括对制造商QMS的审核,以及根据设备分类,对制造商提供的相关技术文件进行评审,为器械符合安全和性能要求(欧盟)或基本要求(英国)提供支持。
BSI荷兰(2797)是领先的全范围认证资质授权公告机构。BSI英国(0086)是英国授权机构,具备全范围认证资质授权。我们评审医疗器械和IVD,确保其符合欧洲和英国的法律要求。
我们秉持最高水平的专业诚信和公正性开展符合性评审和验证活动。
我们的意见会在辩论阶段得到考虑。我们会根据相关法规的要求进行评审。
涉及医疗器械和IVD的设计、开发、营销或维护,或正在接受评审的流程。
我们为您提供产品上市的有效途径。
无论您是刚开始启动认证,还是希望转移认证,或者是需要讨论您面临的各种选择,我们都能引导您顺利完成整个过程。
