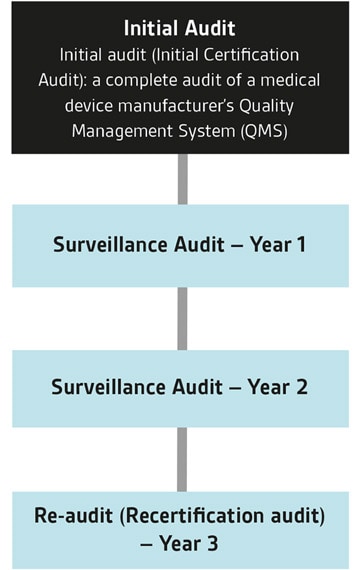
El Programa de Auditoría Única de Dispositivos Médicos (MDSAP) permite una única auditoría del Sistema de Gestión de Calidad (SGC) de un fabricante de dispositivos médicos, que satisface los requisitos de múltiples jurisdicciones reguladoras. Las auditorías son realizadas por Organizaciones Auditoras (OA), como BSI, que están autorizadas por las Autoridades Reguladoras (AR) participantes para auditar según los requisitos del MDSAP.
El MDSAP es una forma de que los fabricantes de productos sanitarios puedan ser auditados y de una vez para comprobar el cumplimiento de la norma y los requisitos reglamentarios de hasta cinco mercados diferentes de productos sanitarios: Australia, Brasil, Canadá, Japón y Estados Unidos.
Una auditoría MDSAP de BSI también puede combinarse con la evaluación para CE e ISO 13485.
Las auditorías MDSAP pueden ser realizadas por un organismo auditor MDSAP reconocido, como BSI. Hemos estado activos desde el inicio de la fase piloto del MDSAP, y ahora hemos completado un número significativo de auditorías MDSAP, predominantemente de fabricantes de dispositivos médicos líderes en el mundo.