Propuesta de la Comisión Europea sobre los plazos de transición del IVDR
Revisión de las disposiciones transitorias del IVDR
REGLAMENTO (UE) 2022/112 DEL PARLAMENTO EUROPEO Y DEL CONSEJO de 25 de enero de 2022 por el que se modifica el Reglamento (UE) 2017/746 en lo que respecta a las disposiciones transitorias para determinados productos sanitarios para diagnóstico in vitro y la aplicación diferida de las condiciones para los productos in-house.
https://eur-lex.europa.eu/eli/reg/2022/112/oj/eng
El 14 de octubre de 2021, la Comisión Europea propuso modificar el período de transición de los productos contemplados en el Reglamento sobre diagnóstico in vitro (IVDR) 2017/746. Esta propuesta, elaborada con carácter de urgencia, para modificar las disposiciones de aplicación del IVDR responde a las circunstancias excepcionales asociadas a las importantes diferencias entre el Reglamento y la Directiva sobre IVD. Además, el paso al IVDR se ha visto sustancialmente afectado por la pandemia de COVID-19 y el impacto que ha tenido en el volumen de productos IVD disponibles después de la fecha de aplicación (DoA), el 26 de mayo de 2022.
La propuesta deberá ser aprobada por los Estados miembros y publicada en el Diario Oficial de la Unión Europea (DOUE) antes de entrar en vigor. En este momento, no podemos informar de cuándo se producirá la publicación aprobada. Una vez en vigor, la fecha de aplicación del IVDR permanecerá sin cambios a partir del 26 de mayo de 2022, sin embargo, el IVDR tendrá nuevos períodos de transición para los productos comercializados después de esta fecha, sujetos a condiciones.
El siguiente cuadro resume la interpretación de la propuesta por parte de BSI, pero le aconsejamos que lea detenidamente el documento publicado y comprenda las implicaciones para su empresa.
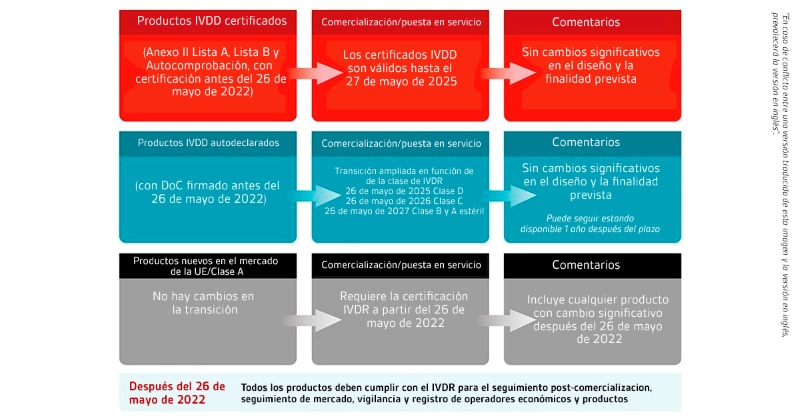
Plazos de transición propuestos IVDR
Aunque la propuesta retrasa los plazos de transición para los productos IVD, la fecha de aplicación no cambiará. Los plazos de transición dependen de que la Declaración de Conformidad según el IVDD se firme antes de la fecha de aplicación y de que posteriormente no se produzcan cambios significativos en el producto. Si un producto sufre un cambio significativo, tal y como se define en el IVDR, se aplicarán todos los requisitos del IVDR, incluida la evaluación de la conformidad por parte de un organismo notificado según la nueva clasificación del producto.
Los plazos de transición significan que para los nuevos productos IVD (es decir, los productos que no tienen un DoC firmado), el IVDR se aplicará en su totalidad a partir del 26 de mayo de 2022.
Todavía hay una montaña que escalar para asegurar que todos los productos estén certificados según el IVDR a tiempo, por lo que le recomendamos que mantenga su enfoque actual en completar su Documentación Técnica.
Queremos agradecerles a todos sus esfuerzos en los últimos años y la paciencia que han demostrado en estos tiempos sin precedentes.



