歐盟醫療器材法規(medical device regulation, MDR)於 2017 年 5 月 25 日生效,其緩衝期為三年,但歐盟在官方公告 EU 2020/561 發佈了 MDR 適用日期[1]相關規定的修訂。修訂時程變更如下圖一所示。
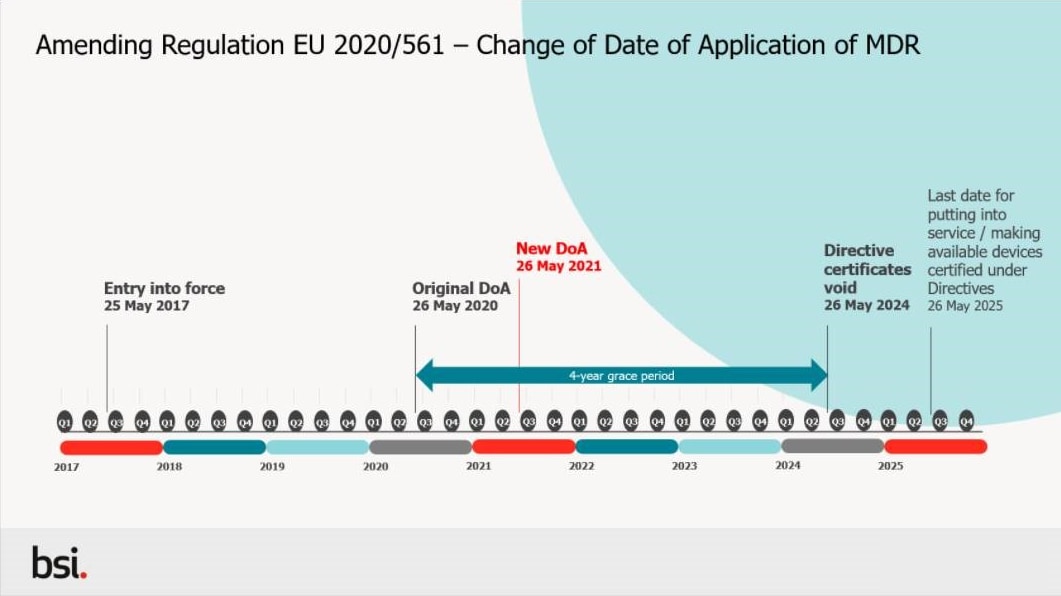
〈圖一〉MDR 生效日期變更時程
現行之主動植入醫療器材指令(AIMDD)(90/385/EEC)與醫療器材指令(MDD)(93/42/EEC將在 MDR DoA 時被廢除,醫療器材法規(MDR)article 120 過渡條款提及,根據 93/42/EEC(Medical device directive, MDD)或 90/385/EEC(active implantable medical device directive, AIMDD)頒發有效證書下的產品可於歐盟醫療器材法規正式生效後具有一定年限的寬限期,製造商可於寬限期內不受部分歐盟醫療器材法規的影響將產品投放使用或投放入歐盟市場,若產品沒有重大的設計或預期用途變更,此寬限期的最終失效日為 2024 年 5 月 26 日。然而,過渡條款中提到,即使是在寬限期內的製造商與其他的經濟營運者(economic operators),仍必須於 2021 年 5 月 26 日後滿足歐盟醫療器材法規中關於 (1)上市後監督、(2)市場監督、(3)警戒、(4)經濟營運者之註冊與 (5)產品註冊的相關要求。
[1] 亦即醫療器材適用 (EU) 2017/745 的適用日期。
相關之上市後監督、警戒系統、經濟營運者之註冊與產品註冊與器材之重大變更評估流程的相關資訊如下:
上市後監督
差異比較請參閱表一。
〈表一〉MDD與MDR上市後監督差異比較表

警戒系統
差異比較請參閱表二。
〈表二〉MDD與MDR警戒系統差異比較表

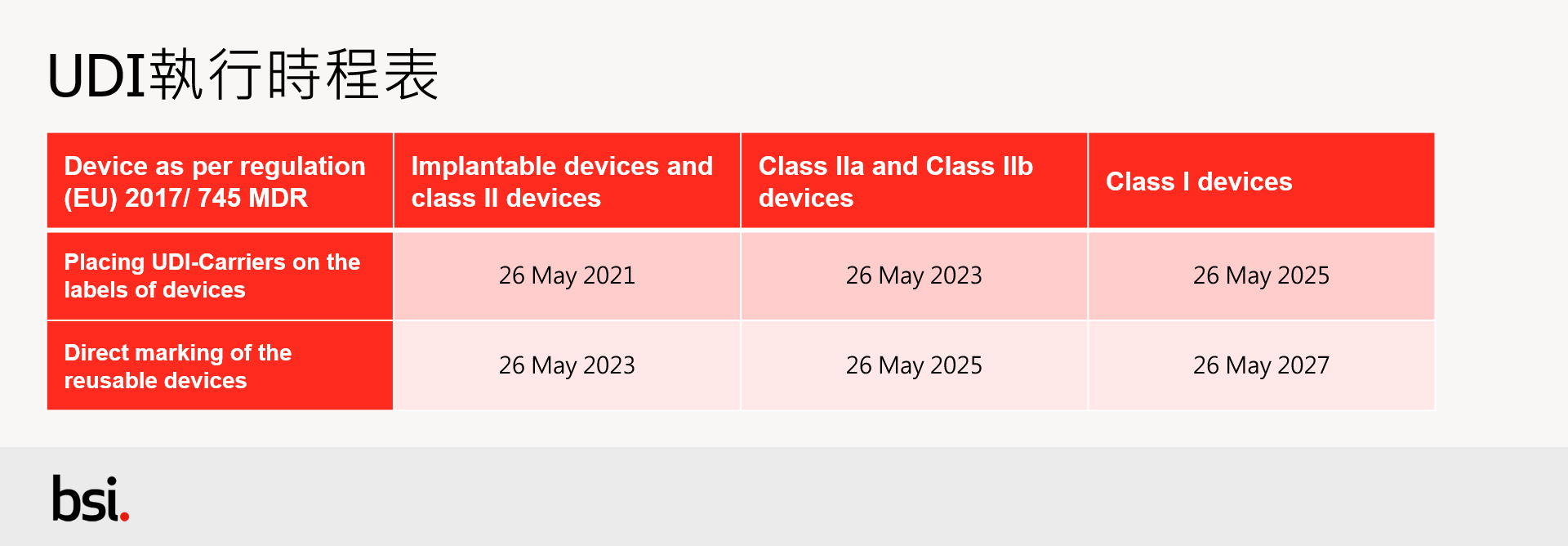
Unique device Identification (UDI)
關於 UDI 的要求遍布歐盟醫療器材法規內,雖然於符合 MDD 與 AIMD 有效證書寬限期內的醫療器材(legacy devices)不受 UDI 要求的約束,但他們仍需於 EUDAMED 資料庫內註冊,所以依據產品風險等級需於特定的時間點前導入 UDI 的要求也適用於這些產品。更多 UDI 相關實行細則可參閱 IMDRF 指引文件,以利理解如何導入與實行 UDI 系統,各等級醫療器材執行時程表請見表三。
〈表三〉UDI執行時程表
經濟營運者之註冊與產品註冊
歐盟醫療器材資料庫(Eudamed)已經開放部分功能,其中包含經濟營運者的註冊,製造商可透過已經公開的資訊先了解部分 Eudamed 的運作方式與已經註冊成功的經濟營運者。
MDR Article 120 (3) 設計或預期用途的重大變更
雖然依據醫療器材法規(MDR)article 120 過渡條款允許根據 MDD、AIMDD 頒發之有效證書可以自 DoA 起在規定的時間內(最終效期為 2024 年 5 月 26 日)將產品投放使用或投放入歐盟市場但前提是這些器材繼續遵守指令規定並且沒有重大設計或預期用途的變動影響其器材,於 2021 年 5 月 26 日後之變更如落於設計或預期用途可能視為重大變更,將需取得 MDR 下的核可後才能繼續將產品銷售往歐盟市場,而製造商的變更通知流程需依據 MDCG 2020-3 與 article 120 (3) 來建立,變更評估流程如下圖二。
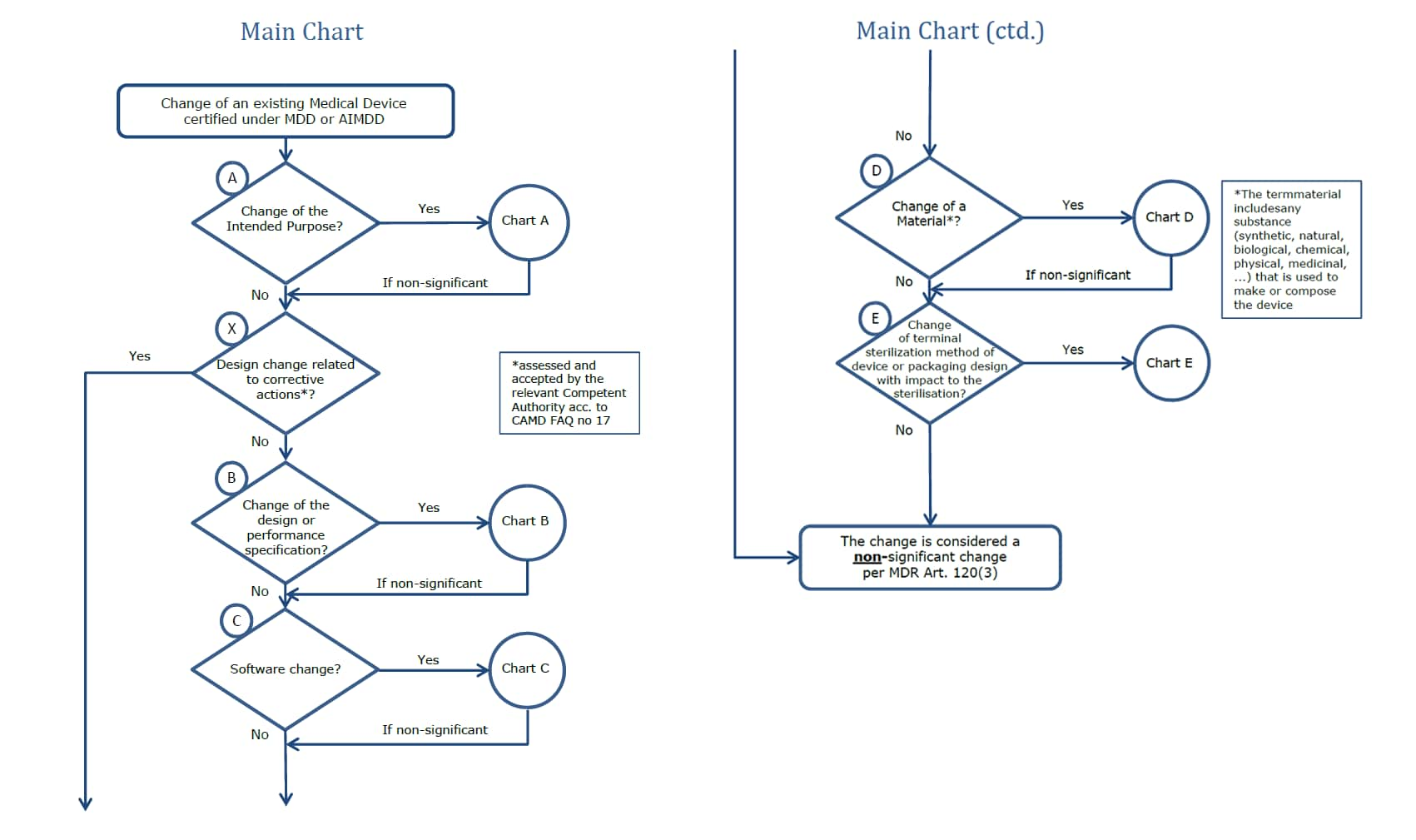
〈圖二〉變更評估流程 reference from MDCG 2020-3
2021 年 5 月 26 日即將到來,廠商們需加緊腳步確認針對過渡條款內所提及之 (1)上市後監督、(2)市場監督、(3)警戒、(4)經濟營運者之註冊與(5)產品註冊的相關要求是否皆建立完善。而針對產品的相關變更在執行前也需先依據 MDCG 2020-3 與 article 120 (3) 來做評估看看其影響程度,如落於設計或預期用途的重大變更相關後續的對策也需於進一步盡早規劃完善,以利產品可持續順利的於歐盟市場上通行。

BSI 醫療器材產品經理 江孟容(Jaonna Chiang)撰文
2021 年 4 月
Reference:
- (EU) 2020/561, https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32020R0561&from=EN
- BSI compliance navigator for medical device_ Comparison of the articles of the European Medical Devices Directive (93/42/EEC) and the Medical Devices Regulation ((EU) 2017/745)(歐盟MDD和MDR的條款比較), https://www.bsigroup.com/zh-TW/Medical-Devices/mdr-ivdr-smart-support/
- Unique Device Identification (UDI) System under the EU medical devices Regulations 2017/745 and 2017/746, https://ec.europa.eu/health/sites/health/files/md_topics-interest/docs/md_faq_udi_en.pdf
- MDCG 2019-4_Timelines for registration of device data elements in EUDAMED, https://ec.europa.eu/docsroom/documents/34921/attachments/1/translations/en/renditions/pdf
- MDCG 2020-15 MDCG Position Paper on the use of the EUDAMED actor registration module and of the Single Registration Number (SRN) in the Member States, https://ec.europa.eu/health/sites/health/files/md_sector/docs/2020-15-position-paper-actor-registration-module_en.pdf
- MDCG 2020-3 Guidance on significant changes regarding the transitional provision under Article 120 of the MDR with regard to devices covered by certificates according to MDD or AIMDD, https://ec.europa.eu/docsroom/documents/40301


