
Recursos de la AIMD
Obtenga más información sobre cómo nuestro equipo de implantes activos puede apoyar sus presentaciones y certificaciones de dispositivos médicos.

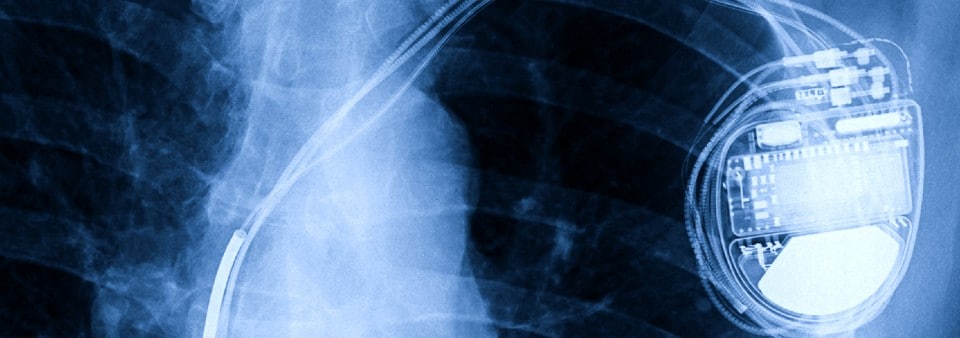

Como fabricante de dispositivos médicos o implantables activos, debe asegurarse de que cumple los requisitos reglamentarios pertinentes antes de comercializar su producto; en el caso de la UE, estos se describen en el Reglamento de Productos Sanitarios (MDR) (UE) 2017/745 y, en el caso de Gran Bretaña, en la Parte III del Reglamento de Productos Sanitarios de 2002 (modificado).
Es fundamental trabajar con un organismo notificado de la UE o con un organismo autorizado del Reino Unido que entienda el sector y tenga la experiencia necesaria para revisar y confirmar la preparación de su producto para el mercado, de forma eficiente, fiable y rápida. Nuestros especialistas técnicos tienen una amplia experiencia en productos sanitarios AIMD y pueden ayudarle en el proceso de certificación de su producto.
BSI Países Bajos (2797) es un organismo notificado líder; revisamos los productos sanitarios para garantizar que cumplen los requisitos de las directivas y reglamentos europeos. BSI Reino Unido (0086) es un Organismo Aprobado del Reino Unido capaz de proporcionar evaluaciones de conformidad bajo el nuevo esquema UKCA.
Descargue nuestro whitepaper

Descargue las directrices del MDR

Vea nuestros webinars bajo demanda