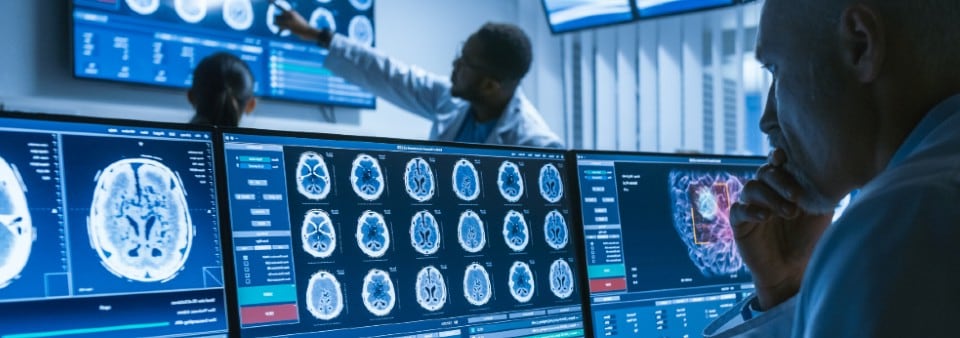
¿Es mi Software un producto sanitario?
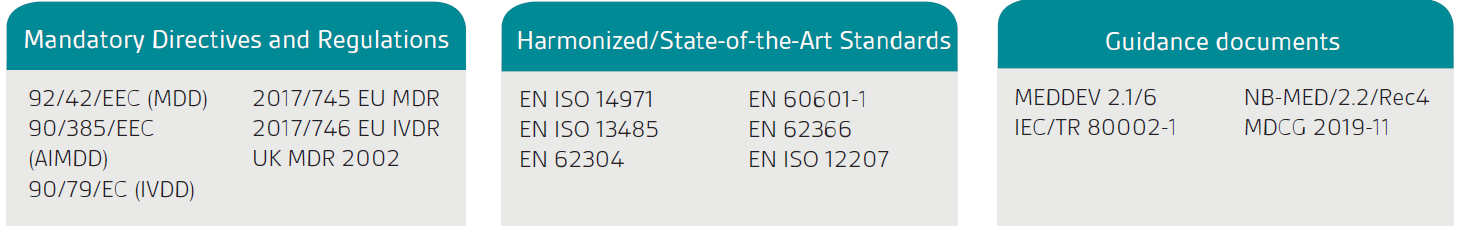
La primera etapa es confirmar que su producto o servicio está clasificado legalmente como un Software Producto Sanitario (SaMD); el producto debe primero tener un uso previsto declarado que sea médico según lo definido por las Directivas sanitarias y el Reglamento de la UE y el Reglament de Productos Sanitarios del Reino Unido (UK MDR) 2002.
La guía de la Comisión Europea, MEDDEV 2.1/6, solo se aplica al software independiente.
Como se indica en el MDR/MDD de la UE y en el MDR del Reino Unido, se considera que un software autónomo que tiene un propósito médico es un producto sanitario activo. La clasificación depende del riesgo para el paciente y los usuarios. Para clasificar completamente su software deberá revisar las reglas de clasificación relevantes.