醫療器材單一稽核計畫(MDSAP)已在澳洲、巴西、加拿大及美國試行,BSI 率先取得資格可執行 MDSAP 稽核發證,BSI 台灣分公司目前接受醫療器材製造商申請,預計今年四月後即可由本地稽核員進行 MDSAP 稽核。
IMDRF 與 MDSAP 現況
國際醫療器材法規管理論壇(International Medical Device Regulators Forum, IMDRF) 是由各國醫療器材主管機關所發起的國際性組織,旨在促進國際醫療器材法規調和。於2011 年 10 月成立,目前的管理委員會(Management Committee)成員包含澳洲、巴西、加拿大、中國、歐盟、日本、俄羅斯及美國。另有正式觀察員*,如世界衛生組織(WHO),及副會員**,如亞洲醫療器材法規調和會(AHWP)。IMDRF 各工作項目設有工作小組(Working Group),醫療器材單一稽核計畫(Medical Device Single Audit Program, MDSAP)即為其中之一,目標建立會員間對醫療器材稽核的接受機制。目前MDSAP工作小組已完成多份文件制定,包含對稽核組織(Auditing Organization)和監管機構(如TGA、FDA等)的要求及策略、流程和方法,對於加入MDSAP的國家具有強制力。
MDSAP 之實施將使醫療器材製造商的品質管理系統,在接受監管機構認可的稽核組織稽核發證後,該證書與稽核報告可作為參與 MDSAP 國家的醫療器材主管機關審查時的重要依據或參考,無須重複查廠。可達到以下效益:
- 提升與改善醫療器材的安全與監控
- 提升監管機構效率
- 節省醫療器材製造商接受重複稽核的成本
自 2014 年開始,MDSAP 已開始在澳洲、巴西、加拿大及美國試行,亦即目前取得的MDSAP 證書與稽核報告將作為前述四個國家主管機關審查時的重要依據或參考。四個試行國家的 MDSAP 證書與稽核報告運用情形如下圖:

*正式觀察員(Official Observer):不參與管理委員會決策,但熟知所有相關事務。**副會員(Affiliate Organizations):可能受邀列席管理委員會會議。
BSI 開始受理醫療器材廠商 MDSAP 申請
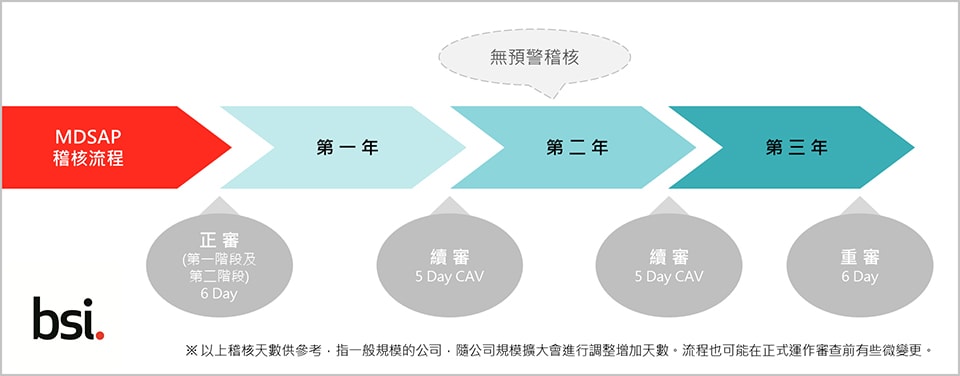
稽核組織需經監管機構的認可,方能執行 MDSA P稽核。BSI 已率先通過條件審查以及現場稽核(Witnessed Audit),目前已可執行 MDSAP 稽核發證。BSI台灣分公司預計今年四月後即可由本地稽核員進行 MDSAP 稽核,目前可受理申請。MDSAP 的稽核週期為三年,正審包含品質管理系統的第一階段和第二階段稽核,隨後兩年每年一次續審,外加一次無預警稽核,三年後重審。取得的 MDSAP 證書與稽核報告可作為澳洲、巴西、加拿大及美國的醫療器材主管機關查時的重要依據或參考。
|