ISO 13485 改定スケジュール
最新情報のご案内
本ご案内は、2015年2月時点の内容です。ISO 13485 の改定に関する最新情報については、特集ページをご参照ください。
2015年2月
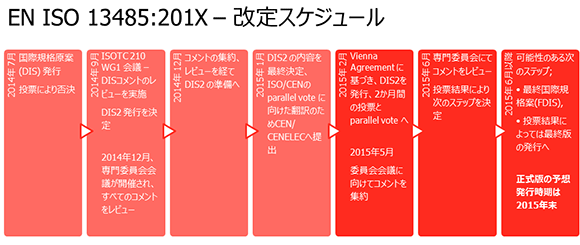
「ISO 13485 DIS2 (Draft International Standard) -Medical Devices - Quality Management Systems – requirements for regulatory purposes」(ISO 13485国際規格原案2 – 医療機器 - 品質マネジメントシステム -規制目的のための要求事項)の内容が、ISO によってパブリックコメント用に公開されました。投票期間は2015年5月5日までとなり、すべてのコメントはこの日までにISO に提出される必要があります。
BSIが国家規格協会である英国国内の組織については、投票は2015年3月12日(木)に締め切られ、3月下旬に予定されているレビュー会議に先立って、コメントの編集作業が実施されます。他の国家規格協会は、異なる投票の締め切り日を設けている可能性があります。
BSIを含むすべての国家規格協会は、文書のレビューを行い、5月5日までにISOにコメントの提出と投票を行います。これらのコメントは、2015年6月にDenver 周辺で開催が予定されている次回のISTC 210 WG1(改定を担当しているISOの専門委員会)のミーティングにおいてレビューされます。このミーティングから、FDIS(最終国際規格案)が登録され、2か月間の投票期間に進むと予想されます。現在の予想では、正式な国際規格としての発行は2015年末になるものとみられます。
◆ISO 13485 改定版の構成について
改定の中心的な内容としては、引き続き、ISO 9001: 2008 に基づくフォーマットに変更される点と、設計に関する要求事項の詳細化となります。新しく発行されるISO 9001: 2015 で採用されるAnnex SL のHigh Level Structure が採用される予定はありません。
このISO 13485 の第3版は、上述の通り、今年発行予定の ISO9001: 2015が採用する新しい規格構成とは整合を取りません。ISO 9001 とISO 13485 の両方の認証を取得している医療機器メーカーは、この点に注意し、旧版から最新版の規格への移行計画を策定する必要があります。状況の推移に合わせ、BSI は新しい規格への移行に必要な考慮点などについて、ウェビナー等を通して情報提供をさせていただきます。
予想では、ISO 9001: 2015には、ISO 9001: 2008 との規格条項の対比表が提供されると考えられます。ISO 13485 においても、現在のISO 13485 に記載のあるように、ISO9001との対比表も掲載されると考えられます(例:ISO 13485: 201x とISO 9001: 2008 との対比表)。
◆お問合せ
ISO DIS 13485に関するお問い合わせは、UKISO13485@bsigroup.comまで、英語にてお寄せください。
Paul Sim
Chairman BSI Standards Committee – CH 210