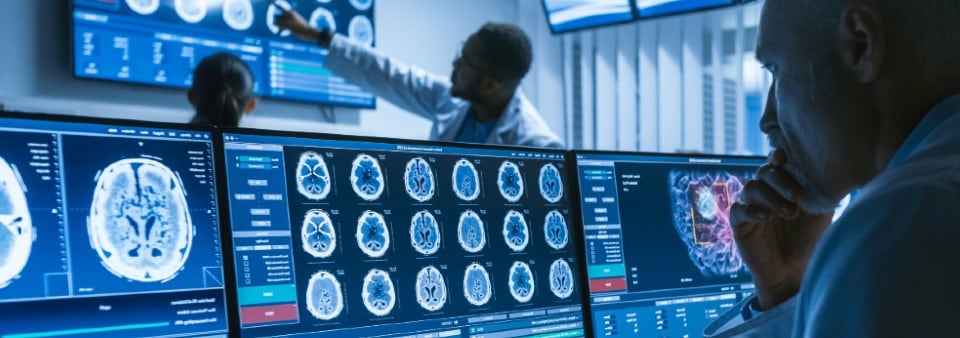
Il mio software è un dispositivo medico?
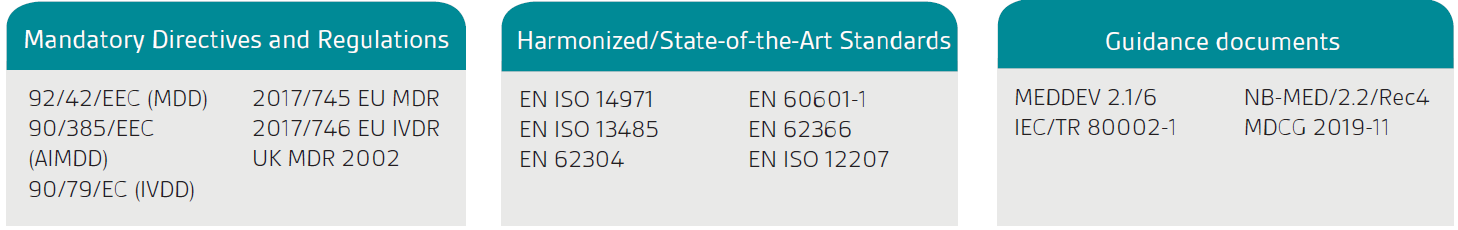
La prima fase è confermare che il tuo prodotto o servizio è legalmente classificato come SaMD; il prodotto deve prima avere uno scopo previsto medicale dichiarato come definito dalle direttive e dal regolamento sui dispositivi medici nell'UE e dal regolamento sui dispositivi medici del Regno Unito (MDR del Regno Unito) 2002.
La European Commission’s guidance, MEDDEV 2.1/6, è applicabile solo al software standalone.
Come indicato nell'MDD / MDR dell'UE e nell'MDR del Regno Unito, il software autonomo che ha uno scopo medico è considerato un dispositivo medico attivo. La classificazione dipende dal rischio per il paziente e gli utenti. Per classificare completamente il software, sarà necessario rivedere le regole di classificazione pertinenti.